CN
CN

在2025年美国血液学会(ASH)年度会议上,成都赜灵生物医药科技有限公司(“赜灵生物”)公布其自主研发的、具有同类最佳(best-in-class)潜力的JAK2/FLT3/CDK6三靶点抑制剂——马来酸氟诺替尼(flonoltinib maleate,FM)在骨髓纤维化(myelofibrosis,MF)中的IIb期临床研究取得积极顶线结果。
在该项IIb期研究中,FM对比一线中高危骨髓纤维化标准治疗药物芦可替尼(ruxolitinib)显示出更优的疗效表现。FM的低剂量组与高剂量组均达到主要终点:在第24周,达到脾脏体积缩小≥35%(spleen volume reduction ≥35%,SVR35)的患者比例获得统计学显著或临床意义改善;研究同时达到关键次要终点——总症状评分降低≥50%(TSS50)。值得一提的是,在现有标准治疗基础上进一步提升TSS50往往具有挑战性,而本研究中FM高剂量显示出较阳性药物芦可替尼高近一倍的症状改善。


牛挺教授在大会作口头报告并分享研究进展
研究方法与基线特征
该多中心、随机、阳性对照IIb期研究共入组75例≥18岁、DIPSS中危-2或高危的MF患者,按1:1:1随机分组接受FM 50 mg QD、FM 100 mg QD或芦可替尼(说明书剂量)。截至2025年12月,来自24个中心的患者均完成入组。三组基线总体可比,但FM组基线总体更差,纳入了更多血细胞减少(骨髓耗竭)表型、原发性骨髓纤维化(PMF)以及骨髓纤维化评级为3级的患者;所有受试者均完成第24周CT/MRI评估,并由盲态独立评审委员会(BIRC)判读。
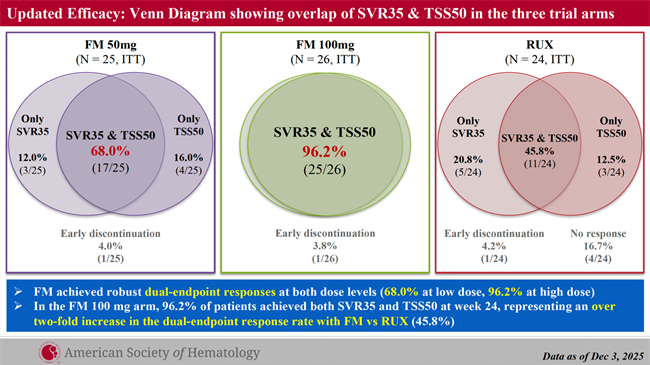
主要与关键次要终点
在主要终点SVR35上,高剂量FM组的应答率为96.2%,而芦可替尼组为66.7%(p=0.009)。症状改善方面亦呈现一致趋势:高剂量组96.2%的患者达到TSS50,较芦可替尼组高出37.9个百分点(p<0.001)。即使在低剂量FM组,也观察到SVR35的临床意义改善以及相较芦可替尼在TSS50上的统计学显著优势(p=0.012),提示FM在两个剂量水平上均呈现显著临床获益。更为关键的是,高剂量FM组在国际公认的“双终点”上展现出突出的重叠应答:第24周,96.2%的高剂量FM患者同时达到SVR35与TSS50;相比之下,低剂量FM为68.0%,芦可替尼为45.8%。
骨髓病理与安全性
此外,在骨髓组织学方面,FM组共有20.5%(9/44)的患者显示骨髓纤维化改善(纤维化分级降低≥1级),而芦可替尼组为13.6%(3/22)。上述结果为FM在MF中潜在的疾病修饰(disease-modifying)效应提供了初步支持。总体而言,FM显示出可控且可管理的安全性特征,未观察到超出JAK通路抑制剂预期范围的新的安全性信号。
FM作为首个与骨髓纤维化一线标准治疗芦可替尼开展头对头比较的国产创新药,并取得优效性结果,标志着国产创新药正从“跟随验证”迈向“定义标准”,并为全球一线治疗格局带来潜在的实践改变。赜灵生物表示,公司正在中国推进FM的关键性III期研究,并将启动与美国及欧洲监管机构的沟通,为后续境外临床开发做准备。
赜灵生物创始人、董事长、CEO兼首席科学官陈俐娟教授在声明中表示:“基于本次IIb期研究数据,我们认为FM正在展现出在骨髓纤维化领域高度差异化的潜力。我们的下一步重点是通过中国关键性III期研究进一步验证上述发现,并同步推进美国与欧洲的注册与临床规划,使全球患者未来都有机会从中获益。”
四川大学华西医院牛挺教授表示:“在本研究中,氟诺替尼在缩脾与症状改善方面呈现出快速且深度的疗效,同时安全性可控,并且在基线合并血细胞减少以及CALR突变等患者群体中同样观察到获益。如果后续更大样本研究能够重复这些结果,氟诺替尼有望成为具有改变临床实践潜力的治疗选择。”
中国医学科学院血液病医院(血液学研究所)肖志坚教授补充道:“我们同样对骨髓纤维化改善及应答持久性的早期信号感到鼓舞。这些数据提示氟诺替尼或不仅能够改善症状与缩脾,还有潜力进一步触及骨髓纤维化的疾病生物学本质。”
另外在本次ASH 2025大会期间,赜灵生物还以壁报形式公布了甲磺酸普依司他(purinostat mesylate, PM)在复发/难治性外周T细胞淋巴瘤(r/r PTCL)患者中的IIa期研究阶段性数据。该研究共入组24例患者,截至2025年7月,已有20例完成至少一次疗效评估;在中位随访5.39个月后,可评估患者总体ORR为55.0%(11/20),其中CR 4 例、PR 7例。按剂量分层,11.2 mg/m²组ORR为50.0%(4/8),15.0 mg/m²组ORR为58.3%(7/12),并观察到部分患者获得较为持久的缓解(最长治疗已达16个周期)。安全性方面,PM总体耐受性可控,支持其在r/r PTCL领域的进一步开发。
赜灵生物临床开发负责人梁睿在大会以壁报分享PM研究进展